COMUNICADO INSTITUCIONAL DA PORTARIA SDA Nº 798 DE 10 DE MAIO DE 2023
A Associação Brasileira de Criadores de Suínos (ABCS), com intuito de auxiliar a suinocultura nacional, compilou os principais pontos da nova legislação nesse material. O produtor e os demais envolvidos na cadeia da suinocultura devem estar atentos a norma e sempre buscar os órgãos oficiais como fonte de informação. Vale lembrar que o Serviço de Inspeção de Produtos de Origem Animal – SIPOA de sua região ou à Unidade Técnica Regional de Agricultura – UTRA estão à disposição dos produtores e demais usuários.
COMUNICADO INSTITUCIONAL DA PORTARIA SDA Nº 798 DE 10 DE MAIO DE 2023
Conheça as principais mudanças da nova legislação do Ministério da Agricultura e Pecuária (MAPA) sobre uso de medicamentos em fábrica de ração e quais os principais pontos de atenção. Esta Portaria entra em vigor no dia 1º de junho de 2023.
FICAM REVOGADAS:
I – A Instrução Normativa nº 65, de 21 de novembro de 2006;
II – A Instrução Normativa nº 14, de 15 de julho de 2016; e
III – A Portaria nº 605, de 23 de junho de 2022.
PRAZO PARA A ADEQUAÇÃO:
Os fabricantes produtores rurais terão 180 (cento e oitenta) dias para se adequarem aos procedimentos aqui descritos, contados da data da entrada em vigor desta Portaria.
Ou seja, 28 de novembro de 2023.
IMPORTANTE!
A adequação a Portaria SDA nº 798, traz consigo a necessidade de cumprir também o BPF – Boas práticas de fabricação (Instrução Normativa nº 4, de 2007), uma vez que a autorização por parte do MAPA somente será concedida mediante avaliação da implementação do BPF.
PRINCIPAIS PONTOS DE ATENÇÃO DA PORTARIA SDA nº 798
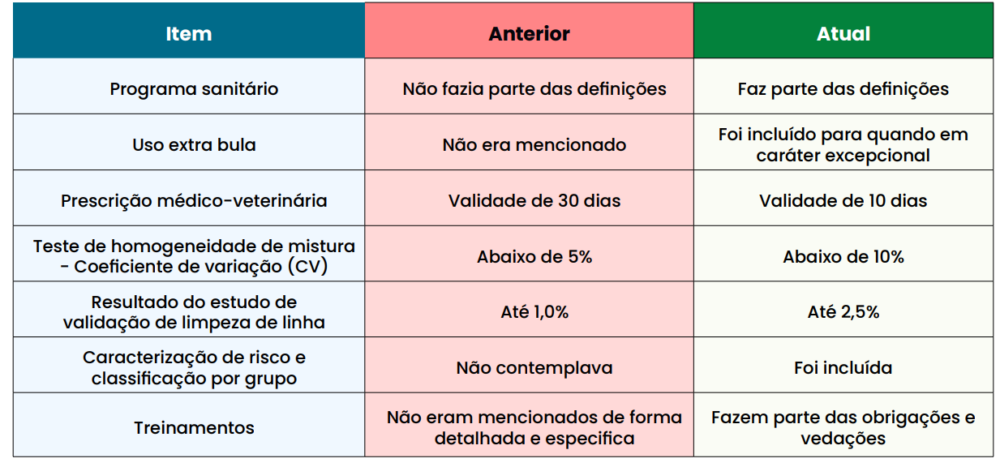
- PROGRAMA SANITÁRIO
Foi incluído nas definições o termo “programas sanitários”. Os mesmos são programas elaborados pelos médicos veterinários que assistem os sistemas de produção integrada, cooperada ou produtores rurais com o objetivo de tratamento profilático de doenças, utilizando os produtos para alimentação animal como veículo.
Este programa deve ser elaborado e reavaliado a cada seis meses sob a responsabilidade de um médico-veterinário e estar disponível em caso de uma fiscalização.
- USO EXTRA BULA (off label)
Somente em caráter excepcional, para tratamento metafilático ou terapêutico serão admitidas doses diferentes àquelas definidas em bula, quando houver apresentação de justificativa e adequação do período de carência com base em referências internacionalmente aceitas.
- PRESCRIÇÃOMÉDICO-VETERINÁRIA
Considerando o emprego de medicamento de uso veterinário, a participação do profissional credenciado para tal, neste caso o médico veterinário, é de suma importância. A prescrição médico-veterinária para casos em que sejam utilizados medicamentos para tratamento ou metafilaxia, passa de 30 dias de validade para 10 dias em todo o território nacional, a contar da data de sua emissão.
- TESTE DE HOMOGENEIDADE DE MISTURA
Para garantir a qualidade da ração, um dos pontos chaves do programa de BPF – Boas práticas de fabricação, é o teste de homogeneidade de mistura que avalia a capacidade do misturador em realizar uma boa mistura.
O resultado pode ser avaliado de duas formas, de acordo com o tipo de teste:
- Teste direto: por meio de contagem de partículas (ex.: marcador inerte de rastreamento, de cor e tamanho uniformes) e neste caso, o resultado deve ser a avaliado com a probabilidade (p);
- Teste indireto: por meio da determinação da concentração de uma substância que esteja amparada em literatura técnico-científica (ex.: mineral) e neste caso, o resultado deve ser a avaliado com o coeficiente de variação (CV).
A interpretação dos resultados dos testes de homogeneidade será feita de acordo com a tabela abaixo:

- RESULTADO DO ESTUDO DE VALIDAÇÃO DE LIMPEZA DE LINHA
Para garantir a não ocorrência da contaminação cruzada, outro ponto chave do programa de BPF – Boas
práticas de fabricação, é a limpeza de linha. O resultado do estudo de validação será considerado satisfatório quando o produto obtido imediatamente após o procedimento de limpeza adotado apresente até 2,5% (dois vírgula cinco por cento) da concentração do princípio ativo constante no produto medicamentoso utilizado no estudo.
- CADASTRO
Para solicitar a autorização para emprego de medicamentos ou produtos medicamentosos, o produtor rural deve se cadastrar em sistema informatizado, disponibilizando dados ao Ministério da Agricultura e Pecuária, os quais serão utilizados exclusivamente para caracterizar o risco de sua atividade. Nesta solicitação deve ser apresentada documentação conforme sua caracterização de risco (vide item 7).
A concessão da referida autorização será publicada no sítio eletrônico do MAPA.
- CARACTERIZAÇÃO DE RISCO E CLASSIFICAÇÃO POR GRUPO
Para fins de emprego de medicamentos ou produtos medicamentosos, os estabelecimentos fabricantes produtores rurais serão caracterizados quanto ao risco de sua atividade, levando-se em conta a quantidade de espécies e categorias para as quais produz e o quantitativo de animais, independentemente do número de propriedades sob sua responsabilidade. Os estabelecimentos fabricantes produtores rurais podem ser classificados em três grupos A, B e C, numa escala crescente de risco, sendo o grupo A o de menor risco e o grupo C de maior risco. Ressalta-se que, havendo enquadramento de um produtor rural em mais de um grupo de risco para a mesma espécie, prevalece o grupo de maior risco. Se houver produção para mais de uma espécie animal, em que uma delas seja suíno ou ave, prevalece o critério mais rigoroso que corresponda a essas duas espécies.
- TREINAMENTOS
Para garantir a educação continuada e a capacitação, os treinamentos são de grande importância e igualmente fazem parte do programa de BPF – Boas práticas de fabricação. Os treinamentos envolvem o uso responsável de medicamentos e produtos medicamentosos e mitigação da resistência aos antimicrobianos no processo produtivo e fazem parte das obrigações e vedações.
Estas determinam que todos sejam treinados (médicos veterinários prescritores, gerentes, supervisores, colaboradores, responsáveis técnicos dos estabelecimentos e produtores rurais) com a devida comprovação.
- RESMO
- MENSAGEM FINAL
Após muitos anos de existência de uma norma que trata do assunto em questão (desde 2006), a publicação da normativa com a sua atual revisão, contou com a participação da cadeia produtiva, por meio da consulta pública. As adequações sugeridas auxiliam na qualidade e é uma forma de resguardar a resistência aos antimicrobianos, consequentemente garantindo a sustentabilidade e a perpetuação da cadeia. Então, para aqueles que ainda têm oportunidades de melhorias, mãos à obra!
- PARA MAIS INFORMAÇÕES E ACESSO À ESTA LEGISLAÇÃO NA ÍNTEGRA, ACESSE: https://www.gov.br/agricultura/pt-br/assuntos/insumos-agropecuarios/insumos-pecuarios/alimentacao-animal/legislacao-alimentacao-animal
- Para tirar possíveis dúvidas sobre esta legislação, acesse “Perguntas e respostas – Fabricantes produtores rurais – Uso de medicamentos e produtos medicamentosos” no link: https://www.gov.br/agricultura/pt-br/assuntos/insumos-agropecuarios/insumos-pecuarios/alimentacao-animal/fabricantes-produtores-rurais/fabricantes-produtores-rurais
- Para acessar a seção da Fábrica de Ração, acesse: https://abcs.org.br/categoria_material/serie-fabrica-de-racao/
Fonte: Acessória de imprensa.
